近日,金沙威尼斯郑直教授、何伟伟教授和美国约翰斯霍普金斯大学医学院毛晓波教授、清华大学化学系李艳梅教授合作,在纳米酶用于神经疾病治疗方面取得新进展。相关研究成果以“Nanozyme scavenging ROS for prevention of pathologicα-synuclein transmission in Parkinson’s disease”为题发表于纳米科学领域著名杂志《Nano Today》(Nano Today,2021,36, 101027, DOI: 10.1016/j.nantod.2020.101027)。
帕金森病(Parkinson’sdisease,PD),是第二大常见的神经退行性疾病,老年人多见,我国65岁以上人群PD的患病率大约是1.7%。帕金森病特征是路易体中的α-突触核蛋白异常聚集和积累。尽管一些帕金森病例与家族性PD相关,但大多数病例是散发性,至今确切病因不明,尚无有效的治疗和预防办法。近年来,德国著名学者Braak提出的分期理论颠覆了对PD的认知。该理论认为,病理性α-突触核蛋白是一种类似病毒的蛋白,在PD大脑中可从一个区域传播到另一个区域,从而加重了PD病理演化。许多新的研究表明,氧化应激水平升高是导致病毒样α-突触核蛋白扩散的关键诱因。那么,如果找到一种能够有效降低氧化应激水平且生物兼容性好的纳米材料,可能会抑制病理性α-突触核蛋白的扩散,无疑会对减轻PD发病具有重要作用。
针对这一跨学科交叉的挑战性难题,郑直教授与何伟伟教授团队结合前期在贵金属纳米酶方面的多年研究积累,与美国约翰斯霍普金斯大学医学院毛晓波教授、清华大学化学系李艳梅教授合作,设计了一种具有良好生物兼容性的PtCu合金纳米酶。抗氧化实验表明,PtCu纳米酶具有类过氧化氢酶、类过氧化物酶和类超氧化物歧化酶等多重模拟酶活性以及清除自由基的能力,这使PtCu纳米颗粒成为抑制活性氧物种产生的出色抗氧化剂。为了评价PtCu纳米颗粒在体外和体内的生物活性,他们进一步建立了α-突触核蛋白预制纤维体(PFF)诱导的帕金森疾病模型。体外细胞实验表明在神经元培养物中添加PFF会引起ROS水平提高,α-突触核蛋白积聚、病理性和神经毒性,而PtCu纳米酶能显著减少由PFF诱导引起的ROS水平、α-突触核蛋白病理性和神经毒性,重要的是能阻断病理性α-突触核蛋白细胞间的传播。基于建立的小鼠散发性PD模型,体内实验表明,PtCu纳米酶处理显著阻止了α-突触核蛋白从纹状体向黑质的扩散。这是第一次发现并证实纳米酶可以阻断α-突触核蛋白的扩散,为纳米酶在PD疾病治疗中的应用提供了新策略。该研究关于纳米酶在阻止α-突触核蛋白的应用有望为阿尔茨海默病等其他神经退行性病变提供治疗和预防参考。
金沙威尼斯2015级本科生毛远洋(现为河南大学研究生,指导老师何伟伟)和清华大学博士刘雨青为该论文的共同第一作者,郑直教授、何伟伟教授和美国约翰斯霍普金斯大学医学院毛晓波教授、清华大学化学系李艳梅教授为该论文的共同通讯作者。该研究得到了国家自然科学基金、河南省高层次人才特殊支持计划、河南省高校科技创新团队、科技部重点研发计划等项目的支持。
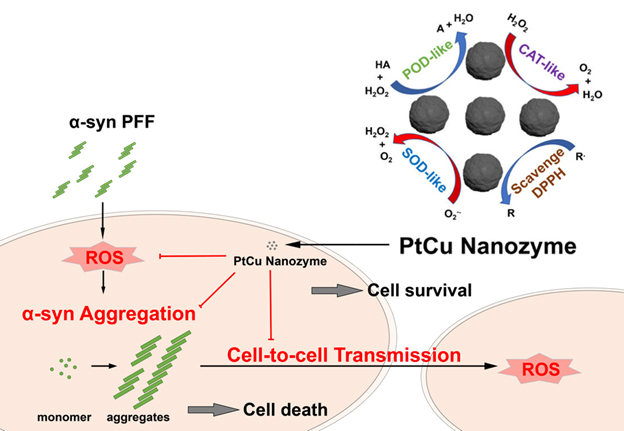
图:PtCu纳米酶清除活性氧物种和阻止病理α-突触核蛋白细胞间传播机理图
 豫ICP备08001014号
豫ICP备08001014号